Det tidlige 20. århundrede var en meget lykkelig tid for videnskaberne. Ud over at Ernest Rutherford og Niels Bohr fødte standardmodellen for partikelfysik, var det også en periode med gennembrud inden for kvantemekanik. Takket være igangværende undersøgelser af elektronernes adfærd begyndte forskere at foreslå teorier, hvorved disse elementære partikler opførte sig på måder, der trodsede klassisk, Newtonsk fysik.
Et sådant eksempel er Electron Cloud Model foreslået af Erwin Schrodinger. Takket være denne model blev elektroner ikke længere afbildet som partikler, der bevæger sig rundt i en central kerne i en fast bane. I stedet foreslog Schrodinger en model, hvor forskere kun kunne komme med uddannede gætte om elektronernes position. Derfor kunne deres placeringer kun beskrives som en del af en 'sky' omkring kernen, hvor elektronerne sandsynligvis findes.
Atomfysik til det 20. århundrede:
De tidligste kendte eksempler på atomteori kommer fra det gamle Grækenland og Indien, hvor filosofer som Democritus postulerede, at al materie var sammensat af små, udelelige og uforglemmelige enheder. Udtrykket "atom" blev myntet i det gamle Grækenland og gav anledning til tankegangen, kendt som "atomisme". Denne teori var dog mere et filosofisk begreb end en videnskabelig.
Først i det 19. århundrede blev atomteorien artikuleret som en videnskabelig sag, hvor de første evidensbaserede eksperimenter blev udført. For eksempel brugte den engelske videnskabsmand John Dalton i begyndelsen af 1800-tallet begrebet atom til at forklare, hvorfor kemiske elementer reagerede på visse observerbare og forudsigelige måder. Gennem en række eksperimenter, der involverede gasser, fortsatte Dalton med at udvikle det, der er kendt som Daltons atomteori.
Denne teori udvidede lovene om samtale med masse og bestemte proportioner og kom ned til fem lokaler: elementer, i deres reneste tilstand, består af partikler kaldet atomer; atomer i et specifikt element er alle de samme, helt ned til det sidste atom; atomer fra forskellige elementer kan fortælles fra hinanden ved hjælp af deres atomvægte; atomer af elementer forenes for at danne kemiske forbindelser; atomer kan hverken oprettes eller ødelægges ved kemisk reaktion, kun grupperingen ændrer sig nogensinde.
Opdagelse af elektron:
I slutningen af det 19. århundrede begyndte videnskabsfolk også at teoretisere, at atomet var sammensat af mere end en grundlæggende enhed. De fleste forskere turdede sig dog, at denne enhed ville være størrelsen på det mindste kendte atom - brint. Ved udgangen af det 19. århundrede ville hans ændre sig drastisk takket være forskning udført af forskere som Sir Joseph John Thomson.
Gennem en række eksperimenter, der anvender katodestrålerør (kendt som Crookes 'Tube), observerede Thomson, at katodestråler kunne afbøjes af elektriske og magnetiske felter. Han konkluderede, at de snarere end at være sammensat af lys, bestod af negativt ladede partikler, der var 1 gange så små og 1800 gange lettere end brint.

Dette modbeviste effektivt forestillingen om, at hydrogenatomet var den mindste enhed af materie, og Thompson gik videre til at antyde, at atomer var delbare. For at forklare atomens samlede ladning, der bestod af både positive og negative ladninger, foreslog Thompson en model, hvor de negativt ladede "korpuskler" blev fordelt i et ensartet hav med positiv ladning - kendt som Plum Pudding Model.
Disse kropuskler blev senere benævnt "elektroner", baseret på den teoretiske partikel, der blev forudsagt af den anglo-irske fysiker George Johnstone Stoney i 1874. Og ud fra dette blev Plum Pudding Model født, så navngivet, fordi den tæt lignede den engelske ørken, der består af blommekage og rosiner. Konceptet blev introduceret til verden i marts 1904-udgaven af UK's Filosofisk magasin, til bred anerkendelse.
Udvikling af standardmodellen:
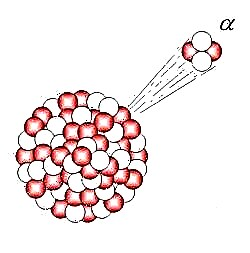
Efterfølgende eksperimenter afslørede en række videnskabelige problemer med Plum Pudding-modellen. Til at begynde med var der problemet med at demonstrere, at atomet havde en ensartet positiv baggrundsladning, som blev kendt som ”Thomson-problemet”. Fem år senere ville modellen blive modbevist af Hans Geiger og Ernest Marsden, der udførte en række eksperimenter ved hjælp af alfa-partikler og guldfolie - aka. "guldfolieeksperimentet."
I dette eksperiment målte Geiger og Marsden spredningsmønsteret for alfapartiklerne med en fluorescerende skærm. Hvis Thomsons model var korrekt, ville alfa-partiklerne passere uhindret gennem den atomære struktur af folien. Imidlertid bemærkede de i stedet, at mens de fleste blev skudt direkte igennem, var nogle af dem spredt i forskellige retninger, mens nogle gik tilbage i retning af kilden.

Geiger og Marsden konkluderede, at partiklerne var stødt på en elektrostatisk kraft, der var langt større end den, der er tilladt af Thomsons model. Da alfapartikler kun er heliumkerner (som er positivt ladede), implicerede dette, at den positive ladning i atomet ikke var bredt spredt, men koncentreret i et lille volumen. Derudover betød det faktum, at de partikler, der ikke blev afbøjet, passeret uhindret, at disse positive rum blev adskilt af store bugter med tomt rum.
I 1911 fortolkede fysikeren Ernest Rutherford Geiger-Marsden-eksperimenterne og afviste Thomsons model af atomet. I stedet foreslog han en model, hvor atomet bestod af stort set tomt rum, med al dens positive ladning koncentreret i dets centrum i et meget lille volumen, der var omgivet af en sky af elektroner. Dette blev kendt som atomets Rutherford-model.
Efterfølgende eksperimenter af Antonius Van den Broek og Niels Bohr forfinede modellen yderligere. Mens Van den Broek antydede, at atomantallet for et element ligner meget dets nukleare ladning, foreslog sidstnævnte en solsystem-lignende model af atomet, hvor en kerne indeholder atomantalet positiv ladning og er omgivet af en lige antal elektroner i orbitalskaller (også kendt som Bohr-modellen).
Electron Cloud-modellen:
I 1920'erne blev den østrigske fysiker Erwin Schrodinger fascineret af teorierne Max Planck, Albert Einstein, Niels Bohr, Arnold Sommerfeld og andre fysikere. I løbet af denne tid blev han også involveret inden for områderne atomteori og spektre, hvor han forskede ved Universitetet i Zürich og derefter Friedrich Wilhelm-universitetet i Berlin (hvor han efterfulgte Planck i 1927).

I 1926 taklede Schrödinger spørgsmålet om bølgefunktioner og elektroner i en række papirer. Ud over at beskrive, hvad der ville blive kendt som Schrodinger-ligningen - en delvis differentiel ligning, der beskriver hvordan kvantesystemets kvantetilstand ændrer sig med tiden - brugte han også matematiske ligninger til at beskrive sandsynligheden for at finde et elektron i en bestemt position .
Dette blev grundlaget for, hvad der ville blive kendt som Electron Cloud (eller kvantemekanisk) model såvel som Schrodinger-ligningen. Baseret på kvanteteori, der siger, at al materie har egenskaber, der er forbundet med en bølgefunktion, adskiller Electron Cloud Model sig fra Bohr-modellen, idet den ikke definerer den nøjagtige bane for et elektron.
I stedet forudsiger det den sandsynlige placering af placeringen af elektronet baseret på en funktion af sandsynligheder. Sandsynlighedsfunktionen beskriver dybest set et skylignende område, hvor elektronet sandsynligvis findes, deraf navnet. Hvor skyen er mest tæt, er sandsynligheden for at finde elektronet størst; og hvor det er mindre sandsynligt, at elektronet er, er skyen mindre tæt.
Disse tætte regioner er kendt som “elektroniske orbitaler”, da de er det mest sandsynlige sted, hvor et kredsløbende elektron findes. Ved at udvide denne “sky” -model til et 3-dimensionelt rum, ser vi et barbell eller blomsterformet atom (som på billedet øverst). Her er de forgrenede regioner dem, hvor vi mest sandsynligt finder elektronerne.
Takket være Schrodingers arbejde begyndte forskere at forstå, at det i kvantemekanikens område var umuligt at vide den nøjagtige position og momentum for en elektron på samme tid. Uanset hvad observatøren oprindeligt ved om en partikel, kan de kun forudsige dens efterfølgende placering eller momentum med hensyn til sandsynligheder.
På intet givet tidspunkt vil de være i stand til at konstatere en af dem. Faktisk, jo mere de ved om en partikels momentum, jo mindre vil de vide om dens placering, og vice versa. Dette er, hvad der i dag kaldes ”usikkerhedsprincippet”.
Bemærk, at orbitaler, der er nævnt i det foregående afsnit, er dannet af et hydrogenatom (dvs. med kun en elektron). Når man beskæftiger sig med atomer, der har flere elektroner, spredes de elektroniske orbitalregioner jævnt i en sfærisk fuzzy kugle. Det er her udtrykket 'elektronsky' er mest passende.
Dette bidrag blev universelt anerkendt som et af de vigtigste omkostninger i det 20. århundrede og et, der udløste en revolution inden for fysik, kvantemekanik og faktisk alle videnskaber. Fra nu af arbejdede forskere ikke længere i et univers, der var kendetegnet ved absolutiteter af tid og rum, men i kvanteusikkerheder og tid-rum-relativitet!
Vi har skrevet mange interessante artikler om atomer og atommodeller her på Space Magazine. Her er hvad er John Daltons atommodel ?, Hvad er blommepuddingmodellen?, Hvad er Bohrs atommodel ?, Hvem var demokrat? Og hvad er delene af et atom?
For mere information, skal du kontrollere, hvad der er kvantemekanik? fra Live Science.
Astronomy Cast har også en episode om emnet, ligesom Episode 130: Radio Astronomy, Episode 138: Quantum Mechanics, og Episode 252: Heisenberg Uncerurity Principle