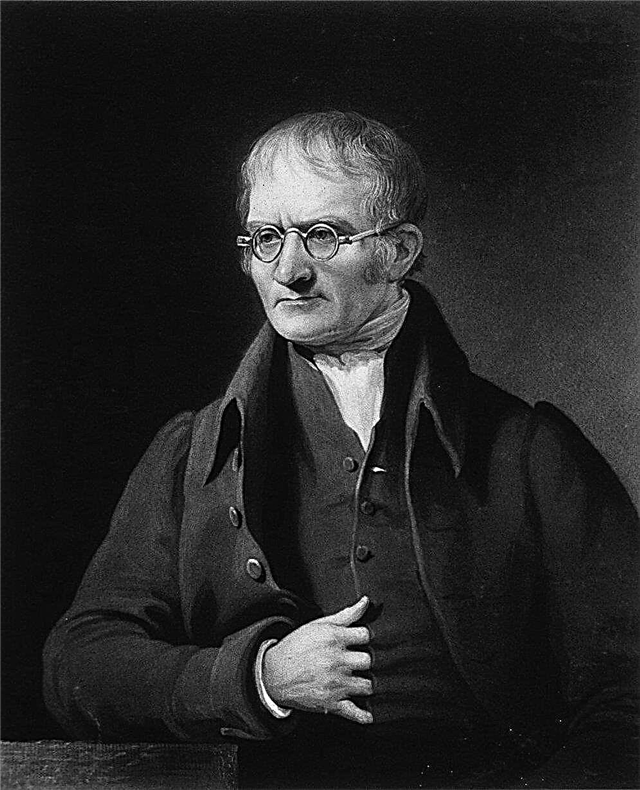Atomteori - det vil sige troen på, at al materie er sammensat af små, udelelige elementer - har meget dybe rødder. Det blev dog ikke omfattet videnskabeligt før i det 19. århundrede, hvor en evidensbaseret tilgang begyndte at afsløre, hvordan atommodellen så ud.
Det var på dette tidspunkt, at John Dalton, en engelsk kemiker, meteorolog og fysiker, begyndte en række eksperimenter, som ville kulminere i ham med forslag om teorien om atomkompositioner - som derefter ville blive kendt som Daltons atomteori - som ville blive en af de hjørnestener i moderne fysik og kemi.
Ud over at skabe en model for atomiske interaktioner, krediteres John Dalton også med at udvikle love for at forstå, hvordan gasser fungerer. Med tiden ville dette føre ham til at konkludere ting om, hvordan atomer interagerede, vægten af atomer og til at designe love, der etablerer atomteori som videnskabelig disciplin.
Daltons gaslovgivning:
Dalton kom med sin teori om atomer som et resultat af sin forskning i gasser. Dette begyndte i 1800, da Dalton blev sekretær for Manchester Literary and Philosophical Society. Mens han var der, begyndte Dalton indsendt en række essays, der skitserede hans eksperimenter med hensyn til sammensætning af blandede gasser, herunder damptrykket og andre dampe ved forskellige temperaturer, ved fordampning. og på den termiske ekspansion af gasser.
I sine essays beskrev Dalton eksperimenter, hvor han søgte at konstatere damptrykket på forskellige punkter mellem 0 og 100 ° C (32 og 212 ° F). Baseret på hans observationer af seks forskellige væsker konkluderede Dalton, at variationen i damptrykket for alle væsker var ækvivalent, for den samme variation af temperaturen og den samme damp for ethvert givet tryk.
Han konkluderede også, at alle elastiske væsker under det samme tryk udvides lige, når der påføres varme. Yderligere observerede han, at for enhver given ekspansion af kviksølv (dvs. bemærket stigning i temperaturen ved anvendelse af et kviksølvtermometer), at den tilsvarende ekspansion af luft er forholdsmæssigt mindre, jo højere temperatur går.

Dette blev grundlaget som Daltons lov (alias Daltons lov om delvist tryk), der erklærede, at det samlede tryk, der udøves i en blanding af ikke-reagerende gasser, er lig med summen af deltrykket i de enkelte gasser.
Daltons atomteori:
I løbet af denne undersøgelse af gasser opdagede Dalton også, at visse gasser kun kunne kombineres i bestemte proportioner, selvom to forskellige forbindelser delte det samme fælles element eller gruppe af elementer.
Disse eksperimenter bygger på to teorier, der var opstået i slutningen af 1700-tallet, som handlede om kemiske reaktioner. Den første var loven om bevarelse af masse, formuleret af Antoine Lavoisier i 1789, som siger, at den samlede masse i en kemisk reaktion forbliver konstant - dvs. at reaktanterne har den samme masse som produkterne.
Den anden var loven med bestemte proportioner, først bevist af den franske kemiker Joseph Louis Proust i 1799. Denne lov hedder, at hvis en forbindelse er opdelt i dens bestanddele, så vil masserne af bestanddelene altid have de samme proportioner, uanset af mængden eller kilden til det originale stof.
Dalton studerede disse love og bygger på dem og udviklede sin lov i flere proportioner. Denne lov hedder, at hvis to elementer kan kombineres til at danne et antal mulige forbindelser, så vil forholdene mellem masserne af det andet element, som kombineres med en fast masse af det første element, være forhold mellem små, fulde tal.
Med andre ord, elementer kombineres på atomniveauet i faste forhold, der naturligt adskiller sig baseret på forbindelserne, der kombineres, på grund af deres unikke atomvægt. Resultaterne blev grundlaget for Daltons atomiske love eller model, der fokuserer på fem grundlæggende sætninger. T
Den tilstand, at elementer i deres reneste tilstand består af partikler kaldet atomer; at atomer i et specifikt element er alle de samme, helt ned til det sidste atom; at atomer fra forskellige elementer kan fortælles fra hinanden ved hjælp af deres atomvægte; at atomer af elementer forenes for at danne kemiske forbindelser; og at atomer hverken kan oprettes eller ødelægges ved kemisk reaktion, kun grupperingen ændrer sig nogensinde.
Dalton mente også, at atomteorien kunne forklare, hvorfor vand absorberede forskellige gasser i forskellige forhold - for eksempel fandt han, at vand absorberede kuldioxid langt bedre end det absorberede nitrogen. Dalton antagede, at dette skyldtes forskellene i masse og kompleksitet af gassenes respektive partikler.

Faktisk var det netop denne iagttagelse, der antages at være første gang, at Dalton antydede om den antatte eksistens af atomer. I papiret, der vedrørte gasabsorption i vand, som først blev offentliggjort i 1805, skrev han:
”Hvorfor indrømmer vand ikke størstedelen af al slags gas ens? Dette spørgsmål har jeg behørigt overvejet, og selvom jeg ikke er i stand til at tilfredsstille mig fuldstændigt, er jeg næsten overbevist om, at omstændigheden afhænger af vægten og antallet af de ultimative partikler i de forskellige gasser.”
Dalton foreslog, at hvert kemisk element er sammensat af atomer af en enkelt, unik type, og selvom de ikke kan ændres eller ødelægges med kemiske midler, kan de kombineres og danne mere komplekse strukturer (dvs. kemiske forbindelser). Dette markerede den første virkelig videnskabelige teori om atomet, da Dalton nåede sine konklusioner ved at eksperimentere og undersøge resultaterne på en empirisk måde.
Dalton og atomvægte:
Dalton's begyndte også at studere atomvægte baseret på masseforholdene, som de kombinerede i, med brintatomet taget som standard. Imidlertid var Dalton begrænset af råheden i hans laboratorieinstrumenter og det faktum, at han ikke forestillede sig, at atomerne i visse elementer findes i molekylær form, såsom rent ilt (O2).
Han mente også, at den enkleste forbindelse mellem to elementer altid er et atom hver. Dette illustreres bedst med, hvordan han troede, at den kemiske formel for vand var HO, ikke H2O.

I 1803 præsenterede Dalton mundtligt sin første liste over relative atomvægte for et antal stoffer. Dette papir blev udgivet i 1805, men han diskuterede ikke nøjagtigt, hvordan han opnåede disse tal. I 1807 blev hans metode afsløret af hans bekendte Thomas Thomson i den tredje udgave af Thomsons lærebog, Et system for kemi. Endelig offentliggjorde Dalton en fuldstændig konto i sin egen lærebog, Et nyt system for kemisk filosofi, i 1808 og 1810.
Videnskabelige mangler:
Den største fejl i Daltons teori - dvs. eksistensen af både molekyler og atomer - blev senere i princippet rettet i 1811 af Amedeo Avogadro. Avogadro foreslog, at lige store mængder af to gasser ved lige temperatur og tryk indeholde lige mange molekyler. Med andre ord påvirker massen af en gas partikler ikke den volumen, den optager.
Avogadros lov gjorde det muligt for ham at udlede antallet af gassers diatomiske karakter ved at studere de mængder, hvorpå de reagerede. Avogadro var således i stand til at tilbyde mere nøjagtige skøn over den atomære masse af ilt og forskellige andre elementer og gjorde en klar sondring mellem molekyler og atomer. Desværre er disse og andre opdagelser både modsagt og forfinede Daltons teorier.
For eksempel har videnskabsmænd siden opdaget, at atomet - engang antages at være den mindste del af materien - faktisk kan opdeles i endnu mindre elementære partikler. Og hvorimod Dalton blev opfattet som atomer som en enkelt enhed uden nogen adskillelse mellem positive, negative og neutrale ladninger, efterfølgende eksperimenter af J.J. Thomson, Ernest Rutherford og Neils Bohr afslørede en mere kompleks struktur for atomet.

Disse teorier blev senere valideret ved observationer foretaget med elektronmikroskopet. Vi ved også, at atomvægt er et produkt af strukturen i selve atomerne. Derfor betragtes Daltons atommodel i sin reneste form kun som gyldig til kemiske reaktioner. Dette mindsker dog ikke Daltons bidrag til moderne videnskab.
Før hans tid var atomet lidt mere end en filosofisk konstruktion, der blev overført fra den klassiske antik. Daltons banebrydende arbejde gjorde ikke kun teorien til virkelighed, men førte til mange andre opdagelser, såsom Einsteins relativitetsteori og Plancks kvanteteori - to studieretninger, der danner grundlaget for vores moderne forståelse af kosmos.
Vi har skrevet mange interessante artikler om atomteori her på Space Magazine. Her er et om antallet af atomer i universet, hvad er delene af atomet ?, Hvem var demokrat? Bohrs atommodel, og hvad er plumududningsmodellen?
Hvis du vil lære mere om Daltons model, kan du tjekke artiklen fra Central Queensland University om Daltons Atomic-model.
Astronomy Cast har indspillet mange interessante episoder om emnet. Tjek dem ud - Afsnit 138: Quantum Mechanics, Afsnit 378: Rutherford og Atomer og Afsnit 392: Standardmodellen - Intro.